【みなとみらい IP Navigator】次世代抗体医薬の技術動向と特許戦略
この記事の執筆者

弁理士 村松 大輔(プロフィールはこちら)
■専門分野
医薬品、再生医療、細胞培養、組み換えタンパク質、ペプチド製剤、核酸医薬、抗体医薬、細胞外小胞、遺伝子組み換え、遺伝子編集、PCR、次世代シーケンサー、DNA鑑定、バイオインフォマティクス、菌株、質量分析、イムノアッセイ、農業科学、化粧品、食品はじめに:次世代抗体医薬の普及
こんにちは。
みなとみらい特許事務所の弁理士の村松大輔です。
本日は「次世代抗体医薬」について弁理士の視点からお話ししようと思います。抗体医薬の歴史は、抗体薬物複合体(ADC)と二重特異性抗体に代表される「次世代抗体医薬」の登場により、新たな段階に入りつつあります。これらの医薬品は、既に研究開発段階を越え、臨床現場での普及が進んでいます。
2024年の承認動向
この動向を客観的に示すのが、2024年における日本国内の承認実績です。
この年、ADCが2品目、二重特異性抗体が5品目、合計7品目の次世代抗体医薬が承認されました。これは、同年に承認された抗体医薬全16品目の44 %を占めます。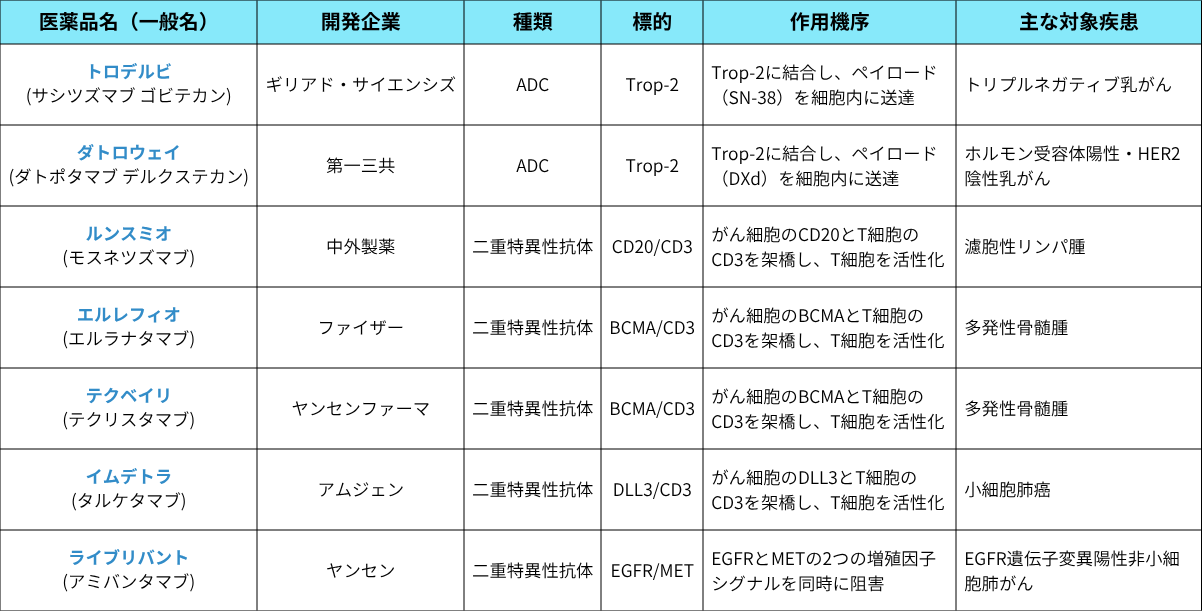
表1:2024年に国内で承認された主要なADCおよび二重特異性抗体 技術の説明
このように臨床現場で普及が進む次世代抗体医薬ですが、その代表格であるADCと二重特異性抗体は、どのような技術なのでしょうか。
ここから、それぞれ詳しく見ていきましょう。抗体薬物複合体(ADC)
抗体薬物複合体(ADC)は、異なる役割を持つ3つのパーツが精密に組み合わさってできた医薬品です。
その構造は、①特定の標的を狙う「抗体」、②強力な攻撃力を持つ「ペイロード(薬物)」、そして③両者をつなぐ「リンカー」から構成されます。それぞれの役割を説明します。
「抗体」は、がん細胞の表面にある特定の目印(抗原)だけを狙って結合する性質(標的特異性)を持っています。これにより、薬物をがん細胞へ正確に誘導する役割を担います。
「ペイロード(薬物)」は、細胞を破壊する非常に強力な作用(細胞傷害活性)を持っています。これは、単体で投与すると正常な細胞にも大きなダメージを与えてしまうほどの力を持っています。
「リンカー」は、この強力なペイロードを抗体に繋ぎ止め、普段はむやみに作用しないように封じ込めておく役割を持ちます。
これら3つの要素が連携することで、ADCは全体として「抗体の標的特異性によってペイロードをがん細胞に選択的に運び、そこで初めてペイロードの強力な細胞傷害活性を解放させる」という効果を発揮します。
この仕組みにより、副作用を抑えながら治療効果を高めるという性質が生まれるのです。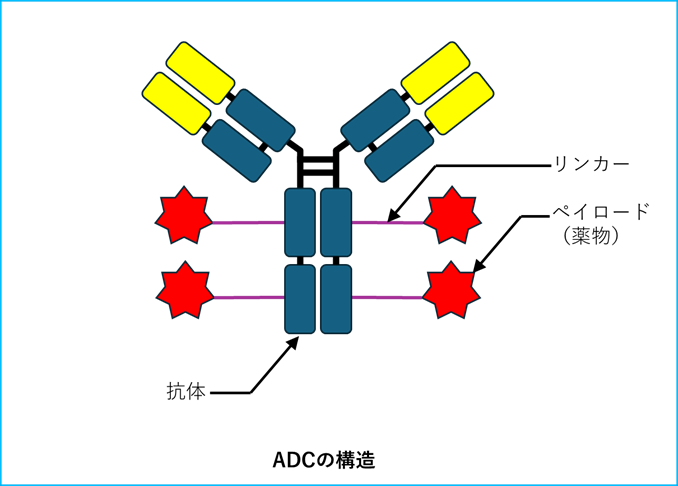
この構造により、ADCはがん細胞に選択的にペイロードを運び、副作用を軽減しつつ治療効果を高めることが期待されます。
ADCはがん細胞の表面に特異的または過剰に発現している抗原を認識して結合します。
がん細胞に結合したADCは、がん細胞内に取り込まれ、酵素によりリンカー部分が切断されることにより、細胞内に薬剤を放出し、がん細胞にダメージを与えます。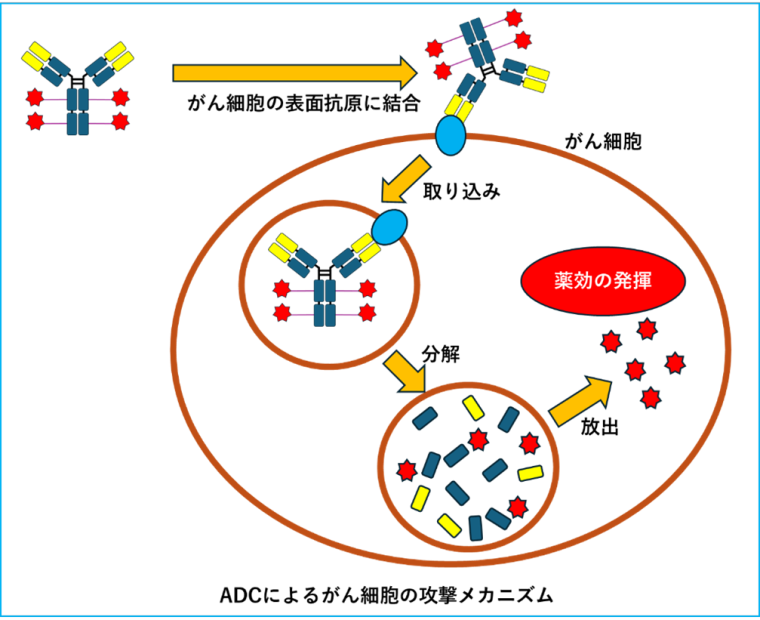
例えば、第一三共の「エンハーツ」は、HER2に対するヒト化モノクローナル抗体とトポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体(薬剤)が、リンカーを介して結合されたADCです。
エンハーツは、腫瘍細胞の細胞膜上に発現するHER2に結合し、細胞内に取り込まれた後にリンカーが加水分解され、遊離したカンプトテシン誘導体(DXd)がDNA傷害作用及びアポトーシス誘導作用を示すこと等により、腫瘍増殖抑制作用を示すと考えられています。特に、放出されたペイロードが周辺のがん細胞にも作用する「バイスタンダー効果」を示し、標的抗原の発現が不均一な固形がんに対して高い有効性を示し、従来の治療法の限界を克服する可能性を提示しています。
二重特異性抗体
二重特異性抗体は、1分子で2つの異なる抗原に結合できる人工抗体です。
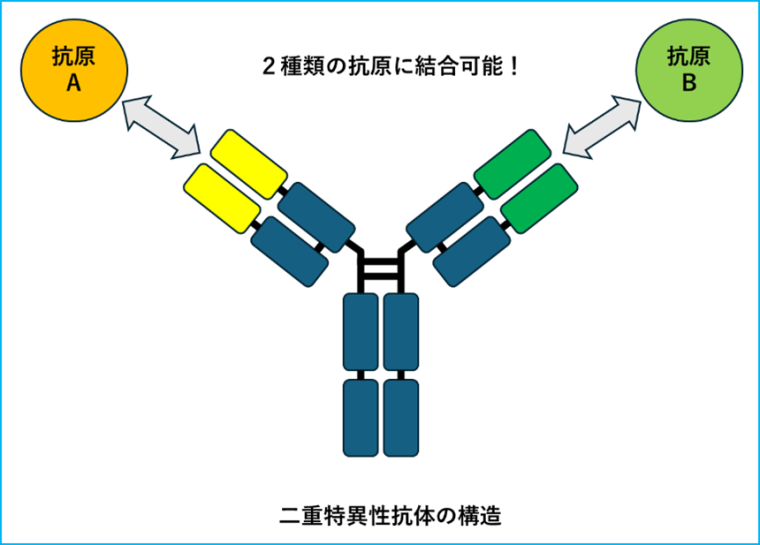
現在主流の「T細胞リダイレクション」タイプは、がん細胞と免疫細胞であるT細胞を物理的に架橋し、T細胞にがん細胞を攻撃させる賢い仕組みです(ルンスミオやエルレフィオなど)。
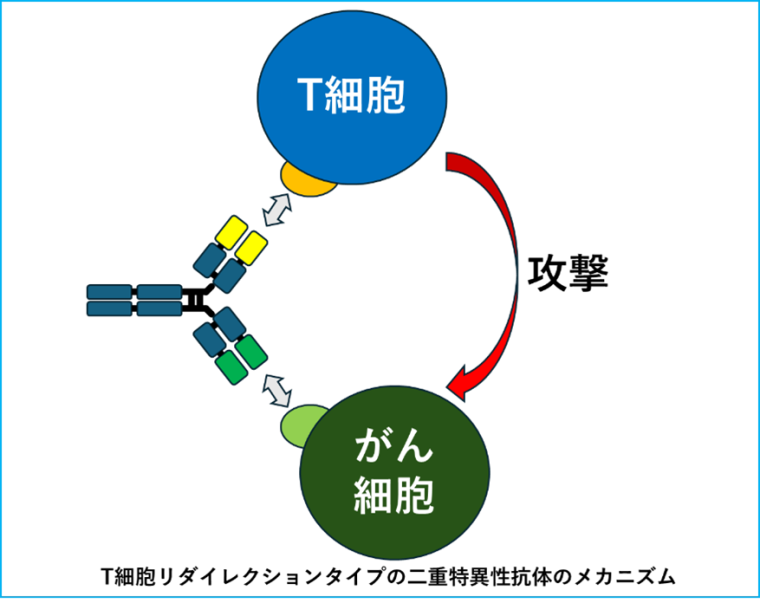
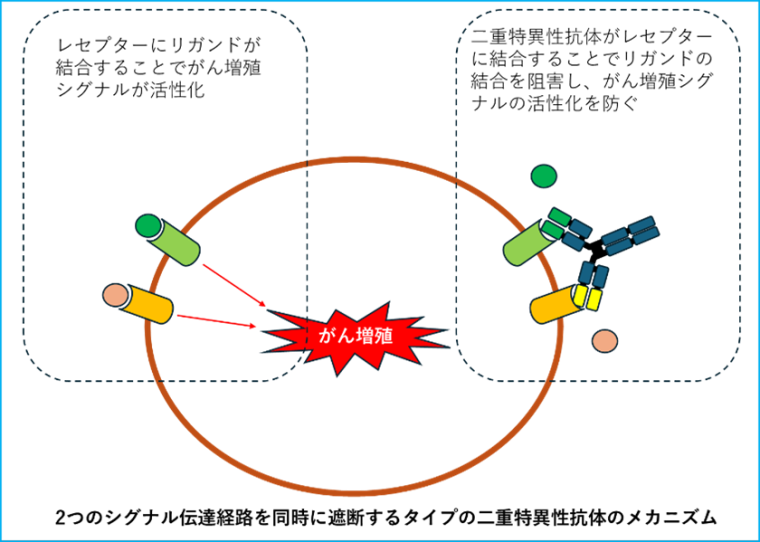
また、がんの増殖に関わる2つのシグナル伝達経路を同時に遮断するタイプ(ライブリバントなど)もあり、多様な治療戦略を可能にしています。
知的財産戦略
技術革新に伴い、その成果を保護するための知的財産戦略も変化しています。
本章では、特許実務における重要な論点を詳細に解説します。【観点1】 Amgen v. Sanofi 判決と抗体特許実務への影響
2023年の Amgen Inc. v. Sanofi 事件に関する米国最高裁判決は、抗体医薬分野の特許実務に大きな影響を与えました。
この判決は、抗体を特定のアミノ酸配列ではなく、「特定の機能を有する」という機能的定義のみで広く権利を主張するクレームについて、米国特許法が定める実施可能要件を満たさないと判断しました。つまり、「ある機能を持つ」というだけで広大な範囲の抗体すべてに特許を認めることはできず、特許明細書には、主張する権利範囲全体を実際に作れるだけの具体的な技術内容を記載する必要がある、という点が明確に示されたのです。
この判決を受けて、クレームの安定性を確保するためには、CDR配列や可変領域配列といった抗体の構造によって発明を特定することが不可欠となります。
【観点2】ADCにおける要素別特許戦略とFTO
ADCは「抗体」「リンカー」「ペイロード」という3つの構成要素から成るため、その特許戦略を考える上では、この複合的な構造をいかに多角的に保護するかが重要となります。
同時に、他社の権利を侵害しないためのFTO(Freedom to Operate)調査も、単一のADC製品が、「抗体」の特許、「リンカー」の特許、「ペイロード」の特許という、それぞれ独立して成立している複数の権利に抵触する可能性があるため、これら3つの観点すべてについて網羅的に調査を行う必要があり、他の医薬品に比べて格段に複雑かつ重要になります。多層的な特許ポートフォリオの構築
ADCは、3つの構成要素それぞれが独立した発明となり得ます。
抗体:新規な標的やエピトープに結合する抗体。
リンカー:新規な化学構造や切断メカニズムを持つリンカー。
ペイロード:新規な構造や作用機序を持つ薬物。理想的な知財戦略は、これら各要素の特許に加え、特定の組み合わせによって初めて生じる相乗効果(例:優れた治療効果など)を保護するADC全体の特許を取得し、多層的な権利網を構築することです。
これにより、競合他社による一部の改変・回避に対しても、多角的な権利行使が可能となります。FTO(Freedom to Operate)調査の重要性
ADCの複合性により、自社製品が第三者の特許権を侵害していないかを確認するFTO分析は極めて複雑かつ重要になります。
特に、ADCの心臓部であるリンカー技術の分野では、特定の「抗体」や「ペイロード(薬物)」を限定せず、リンカーの化学構造を広い一般式で定義した、非常に強力な基本特許が存在します。これは、たとえ自社で全く新しい抗体や薬物を開発したとしても、それらを繋ぐリンカーが、この広範な基本特許の範囲に含まれてしまう可能性があることを意味します。
そのため、新規参入する際には、極めて慎重なFTO調査が不可欠となるのです。ケーススタディ:第一三共 vs. Seagen特許紛争
ADCの特許の重要性を示す象徴的な事例が、第一三共のADC「エンハーツ」を巡るSeagenとの特許紛争です。
紛争の争点は、Seagenが保有するリンカー技術に関する米国特許(’039特許)でした。
この特許は、特定のペプチド配列を含むリンカーを介して、「任意の抗体」と「任意の薬物」を結合させたADCという、非常に広い範囲をカバーするものでした。Seagenは、エンハーツがこの特許を侵害しているとして提訴し、2022年4月、テキサス州の連邦地裁の陪審は第一三共による侵害を認める評決を下しました。
この評決に対し第一三共は不服を申し立てましたが、これと並行して第一三共は、米国特許審判部(PTAB)に対して’039特許の有効性を争う当事者系レビュー(PGR)を申し立てていました。その結果、2024年1月、PTABは「クレームされた広範なADCの属全体を作製・使用する方法が十分に開示されておらず、実施可能要件を満たさない」として、’039特許の主要クレームを無効とする最終判断を下しました。
この判断ロジックは、奇しくも前述のAmgen v. Sanofi判決と軌を一にするものでした。この紛争は、ADCにおけるリンカーのような要素技術の特許が持つ莫大な経済的価値と、広範な機能的クレームが抱える実施可能要件違反による無効化リスクという、二つの側面を明確に示しています。
【観点3】ケーススタディ:エルレフィオ vs. テクベイリ
次世代抗体医薬の知財戦略を具体的に理解するため、特に興味深い事例を見てみましょう。
表1に示した通り、ファイザーの「エルレフィオ」とヤンセンの「テクベイリ」は、標的も作用機序も同じ多発性骨髄腫治療薬でありながら、市場で共存しています。
なぜ、このような直接的な競合品同士で、特許紛争が起きていないのでしょうか。この事例は、現代の抗体医薬における知財と事業戦略の核心を浮き彫りにします。
その理由は、「独占が不可能な市場で、いかにして事業を成立させるか」という両社の現実的な戦略にあると考えられます。
まず、両社が開発に着手した時点で、「BCMAとCD3に結合する」という広いコンセプトは、先行文献の存在(WO2012/066058:出願人=ベーリンガー・インゲルハイム、アムジェン)や【観点1】で述べた実施可能要件の観点から、独占することは不可能でした。
それでも両社が開発を進めたのは、3兆円超と予測される多発性骨髄腫治療薬の巨大な市場の魅力と、先行品があってもより優れた薬剤でシェアを狙う「Best-in-class」戦略があったためと思われます。そして紛争回避の鍵は、独占が不可能なゆえに選択した、堅実な権利化戦略にあります。
ファイザーとヤンセンは、各々独自のプラットフォームによって独自の抗体構造に到達し、それぞれ異なる具体的な構造を特定して、二重特異性抗体に関する物の発明の特許を取得しました。この技術的な棲み分けが、互いの権利を侵害しない状況を生み出し、市場での共存を可能にしているのです。
事業戦略と市場展望
企業の動向と戦略
大手製薬企業は、主力製品の特許満了(パテントクリフ)という経営課題に直面しており、その収益補填のために有望な技術を持つ企業とのライセンス契約やM&Aを活発化させています。
特に二重特異性抗体の分野では、その開発の源泉が、技術革新の担い手であるバイオベンチャーに集中している点が特徴的です。
革新的な二重特異性抗体プラットフォーム技術の多くは、こうしたバイオベンチャーで創出され、その後の臨床開発や商業化は、豊富な資金と開発ノウハウを持つ大手製薬企業との技術提携や買収を通じて進められるというエコシステムが形成されています。
テクベイリがGenmab社の技術から生まれたのは、その典型例と言えるでしょう。また、強力な競合品の存在も無視できません。
BCMAを標的とする治療領域では、テクベイリやエルレフィオのような「オフ・ザ・シェルフ(既製品)」の二重特異性抗体と、アベクマやカービクティに代表される「オーダーメイド」のCAR-T療法が激しく競合しています。
この共通のライバルとの競争が、二重特異性抗体同士での消耗戦(特許紛争)を避けさせ、クラス全体の価値向上に目を向けさせる一因となっている可能性も考えられます。経済的側面と将来の課題
次世代抗体医薬の技術的進歩は、高額な薬価という医療経済的な課題も提起しています。
この問題に対し、治療効果を予測するバイオマーカーを同定し、コンパニオン診断薬を開発することで、薬剤を真に必要とする患者に限定して投与し、医療資源の効率化を図るアプローチが重要性を増しています。また、特許訴訟に伴う経済的リスクも事業戦略上の重要な考慮事項です。
敗訴した場合の数百億円規模の損害賠償や販売差止めといったリスクを考慮すると、巨大な市場で共存を選ぶ方が、不確実で高コストな紛争よりも経済的に合理的である、という判断に至りやすくなります。結論
次世代抗体医薬は、がん治療における標準治療として普及期に入りました。
その成功は、革新的な技術、それを保護する知的財産、そして市場のニーズに応える事業戦略が不可分に連携した結果です。今後の知的財産戦略においては、Amgen v. Sanofi判決を踏まえ、機能的クレームへの依存を避け、構造に基づいたクレームで発明を定義することが必須となります。また、製造方法やスクリーニング方法の発明を組み合わせることや、特にADCについては、その構成要素ごとに多層的な権利保護を図ることで、より強固なポートフォリオ戦略を構築することが有効です。
次世代抗体医薬の普及は、個別化医療の進展に大きく寄与する一方、高額な医療費という社会的な課題も提示しています。この課題に対し、特許政策が果たす役割は決して小さくありません。
本記事で解説したAmgen v. Sanofi判決のように、具体的な発明の裏付けがないまま機能のみで定義された広すぎる権利を認めないという司法判断の流れは、持続可能な医療制度の観点からも重要な意味を持ちます。
なぜなら、過度に広範な権利の成立を抑制することは、健全な競争を促し、多様な治療選択肢の創出につながるからです。
結果として、それが市場原理を通じて薬剤へのアクセス性を高め、医療制度全体の持続可能性に貢献する可能性があります。もちろん、革新的な発明へのインセンティブは維持されなければなりません。
発明の価値を正当に保護しつつ、社会全体がその恩恵を受けられるようにする。この難しいバランスを、特許制度の適切な運用を通じて実現していくことが、今後ますます重要となるでしょう。
お気軽にご相談・お問い合せくださいませ
